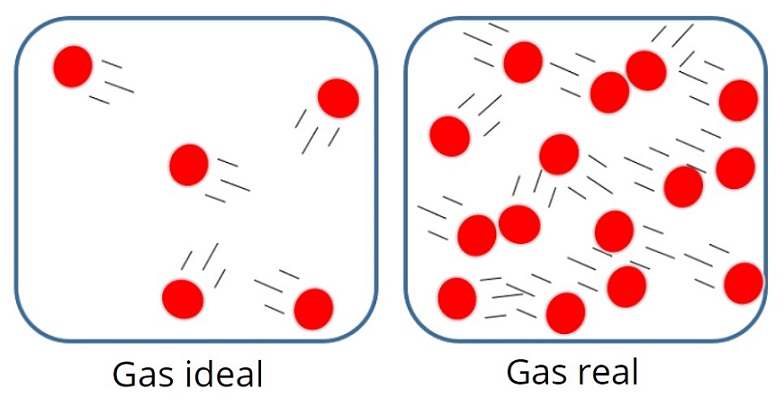
Gas
ideal
Un gas
ideal es aquel gas teórico compuesto por partículas que se mueven al azar y que
no interactúan entre ellas, los gases se comporten de manera ideal cuando se
encuentran a altas temperaturas y presiones bajas, esto es debido a la
disminución de las fuerzas Intermón oculares.
Cuando
un gas se encuentra a muy baja temperatura o bajo condiciones de presión
demasiado altas entonces ya no se está comportando de forma ideal entonces las
condiciones de los gases ya no se cumplen esta ley aplica para condiciones
estándar es decir cuando el gas se encuentra a una atmósfera de presión 273 kelvin
de temperatura absoluta, es decir 0 grados Celsius y cuando ocupa un volumen de
22.4 litros por cada molde sustancia.
La
ecuación del gas ideal, expresión dada en atmósferas v corresponde al volumen
dado en litros t es la temperatura absoluta en kelvin n es el número de mol
cuya unidad es el mol y r es la constante universal de los gases cuyo valor es cero
puntos 0 82 atmósfera por litro sobre mol kelvin.
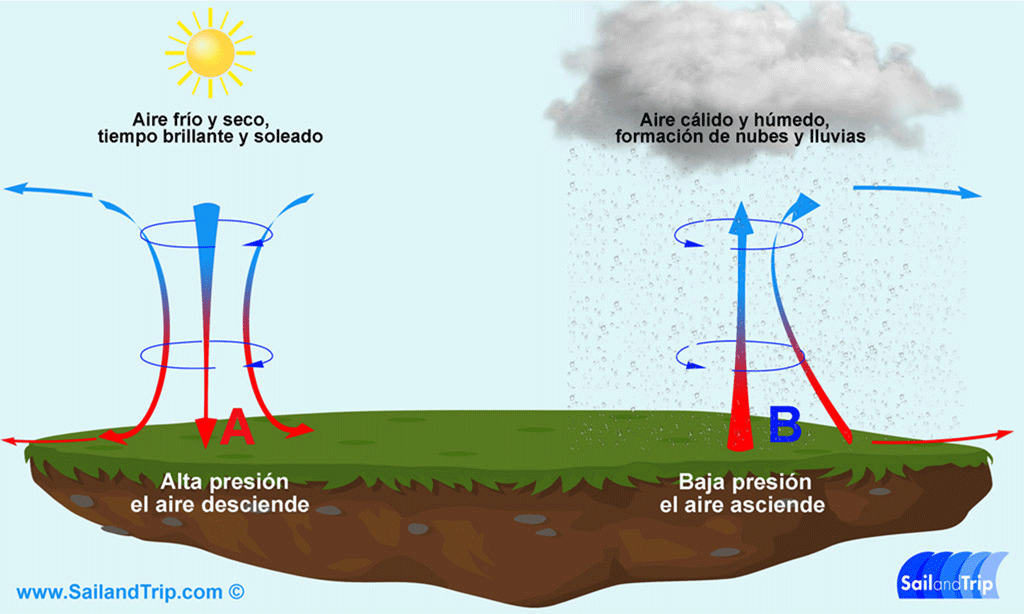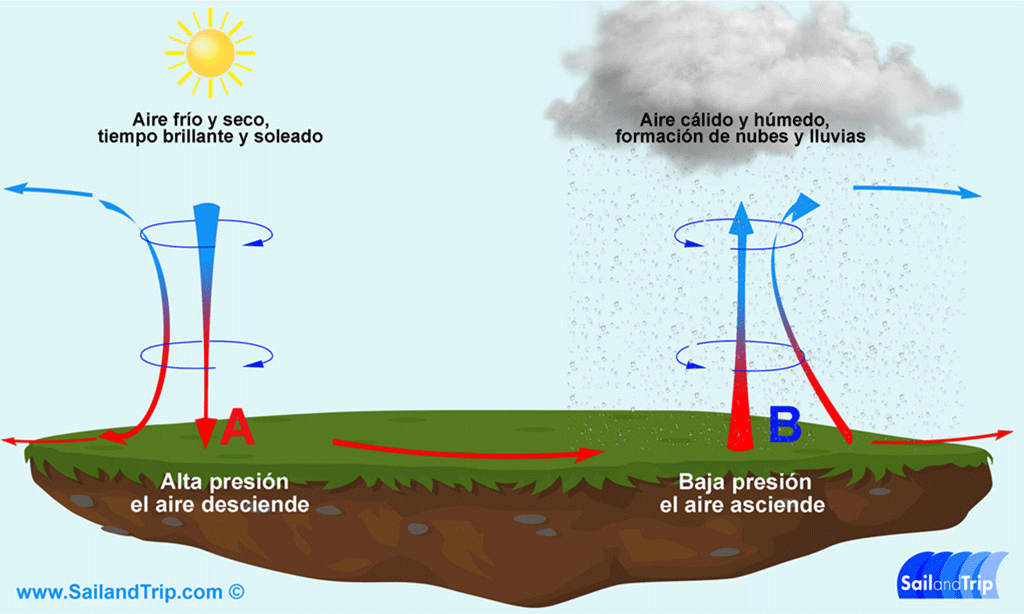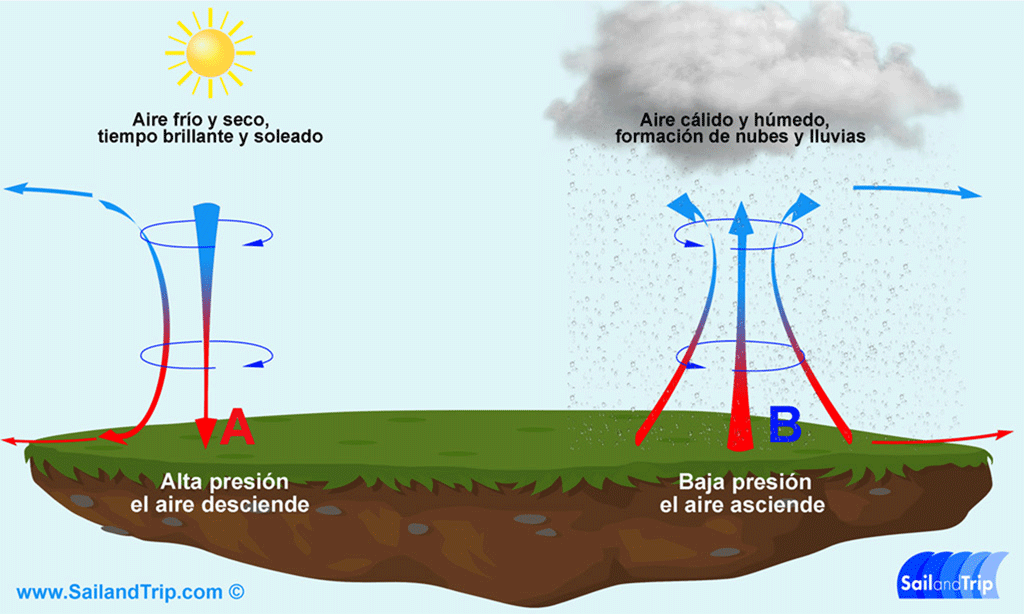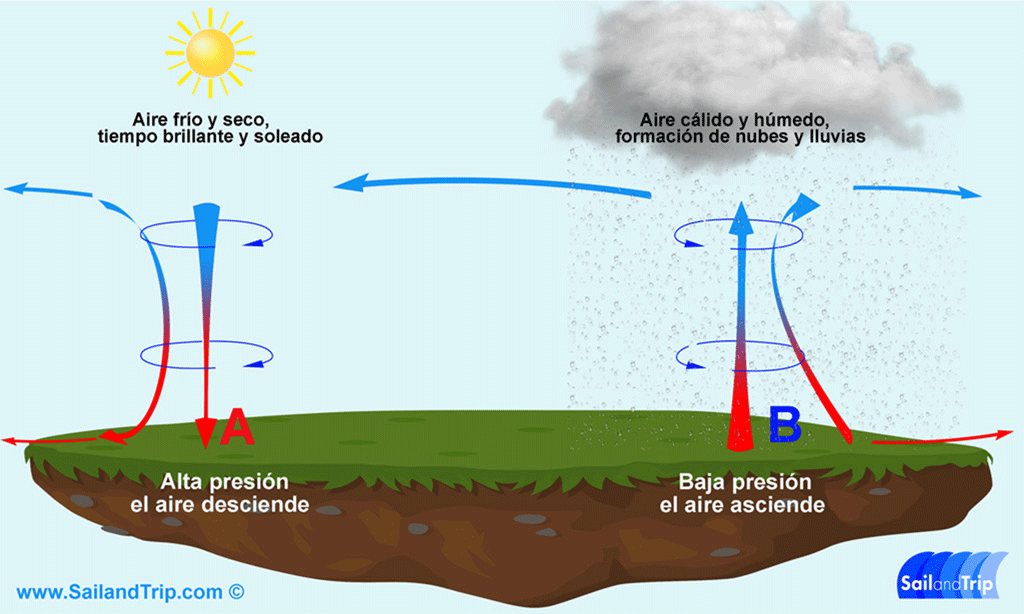
Cuando
se tiene un gas confinado en un recipiente donde puede variar la presión el
volumen o la temperatura, pero manteniendo la masa constante podemos utilizar a
la ley general de los gases esta va a estar determinada por la expresión p 1 b
1 sobre t 1 que es iguala p 2 b2 sobre t 2 esta ecuación relaciona a las tres
variables macroscópicas que son la presión el volumen y la temperatura de modo
que la presión y la temperatura hacen que un gas modifique su volumen mientras
que la presión y el volumen que un gas modifique la temperatura.
Por
último el volumen y la temperatura hacen que un gas modifique su presión por lo
tanto esta ley compara al gas en una etapa inicial con respecto al gas en una
etapa final esta ley también recibe el nombre de ley combinada de los gases ya
que deriva de tres leyes la ley de Boyle Mario la ley de charles y la ley de
gay Lussac comenzamos con la ley de Boyle Mario ésta se conoce también
simplemente como la ley de bollo y aplica para procesos isotérmicos es decir
para aquellos procesos que se Dana temperatura constante esta ley establece que
la temperatura constante la presión es inversamente proporcional al volumen
esto quiere decir que a mayor presión menor volumen y viceversa si la presión
disminuye entonces el volumen aumenta lo tanto va a quedar definida con la
expresión de 1 por b 1 que es igual a p 2 por b2.
Por ejemplo
las
bolsas de aire de un automóvil antes del impacto contienen gas que se encuentra
a una presión elevada por lo tanto ocupan un volumen pequeño cuando el
automóvil impacta la presión disminuye ocasionando que el volumen del gas se
expanda esto hace que la bolsa de aire se infle revisemos ahora a la ley de
charles esta ley aplica para procesos y sobar y cause es decir para aquellos
procesos que ocurren presión constante esta ley establece que a presión
constante el volumen de un gas es directamente proporcional a su temperatura
esto quiere decir que si la temperatura de un gas aumenta por lo tanto también
va a aumentar su volumen y viceversa si la temperatura disminuye entonces el
volumen también va a disminuir de este modo esta ley está definida con la
expresión volumen 1sobre temperatura 1 que es igual a volumen 2 sobre
temperatura 2
Por ejemplo
un
globo que contenga a un gas y que se encuentra de término la temperatura si
esta temperatura aumenta debido a un día soleado entonces el volumen del gas
también va a aumentar ocasionando que este globo se pueda reventar por último
tenemos a la ley de gay Lussac esta ley aplica para procesos históricos o
también denominados hiso volumétricos es decir aquellos procesos que se llevan
a cabo a volumen constante esta ley establece que a volumen constante la
presión de un gas es directamente proporcional a su temperatura esto quiere
decir que si la temperatura aumenta entonces la presión también va a aumentar y
viceversa si la temperatura disminuye por ende la presión también va a
disminuir entonces esta ley queda establecida con la expresión de 1 sobre t 1 que
es igual a p 2 sobre t 2 por ejemplo una olla exprés o de presión hace uso del aumento
de la temperatura para que aumente la presión y de esta forma se cuecen los
alimentos más rápido







No hay comentarios.:
Publicar un comentario